sábado, 27 de diciembre de 2014
viernes, 26 de diciembre de 2014
PRINCIPIO DE LE CHATELIER
Animaciones que muestran como influye la presión y la temperatura en los equilibrios químicos
temperatura en el proceso Haber EXOTÉRMICA
presión en el proceso Haber
Complejo del cobalto ENDOTÉRMICA
redisolución de un precipitado
precipitación de sal
temperatura en el proceso Haber EXOTÉRMICA
presión en el proceso Haber
Complejo del cobalto ENDOTÉRMICA
redisolución de un precipitado
precipitación de sal
AJUSTE REACCIONES QUIMICAS
Algunos ejercicios on-line de ajuste y de cálculos estequiométricos
Ajuste 1
Pincha en el enlace inferior , realiza la reacción con las cantidades indicadas y observa las cantidades finales. Indica el reactivo limitante en cada caso. ¿En cuál de los casos no sobra nada de reactivo?. En ese caso se dice que los reactivos están en cantidades equimoleculares.
a) 28 g de nitrógeno gas y 8 g de hidrógeno gas.
b) 28 g de nitrógeno gas y 6 g de hidrógeno gas.
c) 14 g de nitrógeno gas y 6 g de hidrógeno gas.
d) 28 g de nitrógeno gas y 10 g de hidrógeno gas.
Síntesis del amoníaco
Ajuste 1
Pincha en el enlace inferior , realiza la reacción con las cantidades indicadas y observa las cantidades finales. Indica el reactivo limitante en cada caso. ¿En cuál de los casos no sobra nada de reactivo?. En ese caso se dice que los reactivos están en cantidades equimoleculares.
a) 28 g de nitrógeno gas y 8 g de hidrógeno gas.
b) 28 g de nitrógeno gas y 6 g de hidrógeno gas.
c) 14 g de nitrógeno gas y 6 g de hidrógeno gas.
d) 28 g de nitrógeno gas y 10 g de hidrógeno gas.
Síntesis del amoníaco
jueves, 4 de diciembre de 2014
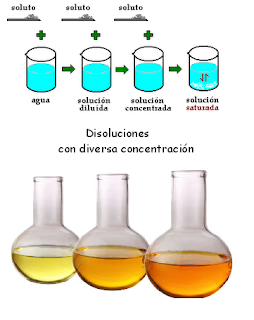
CONCENTRACIÓN DE LAS DISOLUCIONES
CONCENTRACIÓN DE UNA
DISOLUCIÓN
La
disoluciones son mezclas homogéneas de dos o mas sustancias puras denominándose
disolvente al líquido en disoluciones líquidas o al componente que se encuentra
en mayor proporción y soluto a los demás componentes de la disolución.
La
magnitud que indica la cantidad de soluto que hay en una disolución se llama
concentración y según sea esta las disoluciones son diluidas (con poco soluto),
concentradas (con mucho soluto ) o saturadas (si no admiten mas soluto). A
veces la concentración está relacionada con la intensidad del color y podemos
clasificarlas con facilidad por su mayor o menor concentración, tal y como se
aprecia en la figura inferior.
lunes, 24 de noviembre de 2014
TRABAJO LEYES DE LA QUÍMICA
El trabajo vale 0'5 puntos y debe ser enviado al correo electrónico o entrgado antes del dia del examen del tema.
GRUPO A
A partir de la ecuación de estado de gas ideal demostrar: la ley de Boyle, La primera y segunda ley de Gay-Lussac y la hipótesis de Avogadro enunciada en los siguientes términos:.
Hipótesis de Avogadro: a presión y temperatura constantes el volumen de un gas es directamente proporcional al número de moléculas del gas, es decir:
A p y T ctes se cumple que V1/n1 = V2/n2 donde n es el número de partículas.
GRUPO B
Para un gas la distribución de las moléculas que tienen una cierta energía a una temperatura dada sigue la llamada distribución estadística de Mawwell-Boltzmann.
Dibujar dicha distribución y explicarla.
Explicar cómo cambia la distribución al variar la temperatura.
GRUPO A
A partir de la ecuación de estado de gas ideal demostrar: la ley de Boyle, La primera y segunda ley de Gay-Lussac y la hipótesis de Avogadro enunciada en los siguientes términos:.
Hipótesis de Avogadro: a presión y temperatura constantes el volumen de un gas es directamente proporcional al número de moléculas del gas, es decir:
A p y T ctes se cumple que V1/n1 = V2/n2 donde n es el número de partículas.
GRUPO B
Para un gas la distribución de las moléculas que tienen una cierta energía a una temperatura dada sigue la llamada distribución estadística de Mawwell-Boltzmann.
Dibujar dicha distribución y explicarla.
Explicar cómo cambia la distribución al variar la temperatura.
miércoles, 12 de noviembre de 2014
FORMULACIÓN Q. ORGANICA 1993 (PONENCIA SELECTIVIDAD)
En este enlace tenemos las recomendaciones para formular compuestos orgánicos según la ponencia de selectividad , siguiendo las normas IUPAC 1993
Organica IUPAC 1993
Y el cuadro resumen con todo lo que hemos dado y la prioridad de los grupos funcionales:
Enlaces a ejercicios formulació de química orgánica según la IUPAC 1993
ejercicios 1
ejercicios 2 excepto 1g, 4g, 5d y 6b
TEST DE FORMULACION ORGANICA Este enlace es muy recomendable.
Organica IUPAC 1993
Y el cuadro resumen con todo lo que hemos dado y la prioridad de los grupos funcionales:
Enlaces a ejercicios formulació de química orgánica según la IUPAC 1993
ejercicios 1
ejercicios 2 excepto 1g, 4g, 5d y 6b
TEST DE FORMULACION ORGANICA Este enlace es muy recomendable.
lunes, 27 de octubre de 2014
ENLACE METÁLICO
En el enlace metálico los átomos de los metales pierden electrones y se transforman en iones positivos, llamados restos positivos. Los restos positivos se colocan de forma ordenada en una estructura cristalina y los electrones se mueven libremente entre el espacio vacio entre los restos positivos, establilizando la red cristalina.
Este modelo se conoce con el nombre de nube o mar de electrones y explica las propiedades de los metales.
sábado, 18 de octubre de 2014
TEORIA ATÓMICA DE DALTON
Los postulados de la teoría atómica de Dalton son:
La teoría atómica permitía explicar con elegancia las leyes ponderales de la química:
Las leyes de Lavoisier y Proust se explican con facilidad. La de Dalton se explica ya que si dividimos la masa de azufre que se combina con una misma masa (la misma cantidad de átomos) de oxígeno para formar diferentes compuestos, nos debe de salir un número entero que indica cuantos átomos de mas de azufre tiene un compuesto respecto del otro ( en nuestro caso 2 para el segundo compuesto y 3 para el tercero).
En el siguiente enlace podeis encontrar uan explicación muy visual de todo esto:
Teoría atómica de Dalton y leyes ponderales
La teoría atómica permitía explicar con elegancia las leyes ponderales de la química:
Las leyes de Lavoisier y Proust se explican con facilidad. La de Dalton se explica ya que si dividimos la masa de azufre que se combina con una misma masa (la misma cantidad de átomos) de oxígeno para formar diferentes compuestos, nos debe de salir un número entero que indica cuantos átomos de mas de azufre tiene un compuesto respecto del otro ( en nuestro caso 2 para el segundo compuesto y 3 para el tercero).
En el siguiente enlace podeis encontrar uan explicación muy visual de todo esto:
Teoría atómica de Dalton y leyes ponderales
jueves, 2 de octubre de 2014
miércoles, 1 de octubre de 2014
CONFIGURACIONES ELECTRÓNICAS
Orbitales atómicos
orbitales s
orbitales p
En el siguiente enlace puedes ver como se construyen configuraciones electrónicas,siguiendo las reglas explicadas en clase: Configuraciones electrónicas
orbitales s
orbitales p
En el siguiente enlace puedes ver como se construyen configuraciones electrónicas,siguiendo las reglas explicadas en clase: Configuraciones electrónicas
En estos otros dos tenemos ejercicios para que ustedes construyan la configuración y puedan comprobar si lo han hecho correctamente: Ejercicio 1 Ejercicicio 2
lunes, 29 de septiembre de 2014
MODELO DE BOHR
En el siguiente enlace podemos ver una simulación del modelo de Bohr y comprender que ocurre cuando el electrón absorbe o emite radiación electromagnética (luz): modelo de Bohr
Otro enlace que permite visualizar los niveles de energía es niveles de energía
Otro enlace que permite visualizar los niveles de energía es niveles de energía
martes, 23 de septiembre de 2014
EJERCICIOS DE FORMULACIÓN
Pincha en el enlace para acceder a una página web con ejercicios online de formulación IUPAC 2005
martes, 16 de septiembre de 2014
lunes, 15 de septiembre de 2014
UN NUEVO CURSO
Bienvenidos a todos lo alumnos de física y química de 1º bachillerato del IES Llanes a vuestro blog.
Para comenzar el trabajo .... algo suave.
Aquí tenéis ejercicios de formulación para empezar a recordar....
Para comenzar el trabajo .... algo suave.
Aquí tenéis ejercicios de formulación para empezar a recordar....
EJERCICIOS FINALES
Formular:
1- diflúor 2-
ozono
3- agua oxigenada 4-
cloruro de hierro(III)
5- ácido crómico 6- bromuro de berilio
7- pentaóxido de divanadio 8- amoníaco
9- cloruro de hierro(II) 10-
bromo
11- óxido de aluminio 12- pentacloruro
de arsénico
13- tetraóxido de dinitrógeno 14-
monóxido de carbono
15- hidróxido de litio 16- ion
cromo(6+)
17- nitrógeno 18-
siliciuro de niquel(III)
19- sulfuro de hidrógeno 20- cloruro de hidrógeno
21- hidruro de aluminio 22- hidróxido
de cinc
23- fluoruro de calcio 24- ácido
nítrico
25- ácido perclórico 26- sulfuro
de amonio
27- hidróxido de vanadio(V) 28- hidróxido de cinc
29- tetracloruro de carbono 30- óxido de
azufre(VI)
Nombrar:
1- LiNO2 2-
Sn(OH)4
3- Ni (OH)3 4- S2-
5- KH 6- CaH2
7- H2CO3 8-
Cl-
9- Ne 10- HIO3
11- CaO 12- S2O3
13- Pt+2 14-
SO2
Suscribirse a:
Entradas (Atom)