sábado, 27 de diciembre de 2014
viernes, 26 de diciembre de 2014
PRINCIPIO DE LE CHATELIER
Animaciones que muestran como influye la presión y la temperatura en los equilibrios químicos
temperatura en el proceso Haber EXOTÉRMICA
presión en el proceso Haber
Complejo del cobalto ENDOTÉRMICA
redisolución de un precipitado
precipitación de sal
temperatura en el proceso Haber EXOTÉRMICA
presión en el proceso Haber
Complejo del cobalto ENDOTÉRMICA
redisolución de un precipitado
precipitación de sal
AJUSTE REACCIONES QUIMICAS
Algunos ejercicios on-line de ajuste y de cálculos estequiométricos
Ajuste 1
Pincha en el enlace inferior , realiza la reacción con las cantidades indicadas y observa las cantidades finales. Indica el reactivo limitante en cada caso. ¿En cuál de los casos no sobra nada de reactivo?. En ese caso se dice que los reactivos están en cantidades equimoleculares.
a) 28 g de nitrógeno gas y 8 g de hidrógeno gas.
b) 28 g de nitrógeno gas y 6 g de hidrógeno gas.
c) 14 g de nitrógeno gas y 6 g de hidrógeno gas.
d) 28 g de nitrógeno gas y 10 g de hidrógeno gas.
Síntesis del amoníaco
Ajuste 1
Pincha en el enlace inferior , realiza la reacción con las cantidades indicadas y observa las cantidades finales. Indica el reactivo limitante en cada caso. ¿En cuál de los casos no sobra nada de reactivo?. En ese caso se dice que los reactivos están en cantidades equimoleculares.
a) 28 g de nitrógeno gas y 8 g de hidrógeno gas.
b) 28 g de nitrógeno gas y 6 g de hidrógeno gas.
c) 14 g de nitrógeno gas y 6 g de hidrógeno gas.
d) 28 g de nitrógeno gas y 10 g de hidrógeno gas.
Síntesis del amoníaco
jueves, 4 de diciembre de 2014
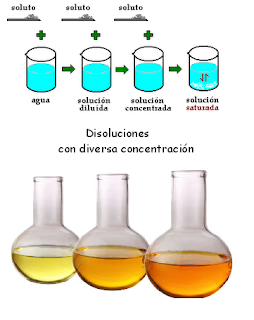
CONCENTRACIÓN DE LAS DISOLUCIONES
CONCENTRACIÓN DE UNA
DISOLUCIÓN
La
disoluciones son mezclas homogéneas de dos o mas sustancias puras denominándose
disolvente al líquido en disoluciones líquidas o al componente que se encuentra
en mayor proporción y soluto a los demás componentes de la disolución.
La
magnitud que indica la cantidad de soluto que hay en una disolución se llama
concentración y según sea esta las disoluciones son diluidas (con poco soluto),
concentradas (con mucho soluto ) o saturadas (si no admiten mas soluto). A
veces la concentración está relacionada con la intensidad del color y podemos
clasificarlas con facilidad por su mayor o menor concentración, tal y como se
aprecia en la figura inferior.
Suscribirse a:
Entradas (Atom)